Uzimanje proteina i/ili aminokiselina stimulira sintezu proteina u mišićima (MPS).
Posebno je važno istaknuti ulogu aminokiseline leucina kao stimulacijskog signala za MPS.
Isto je tako važno znati da sami leucin ne može stimulirati porast MPS u odsutnosti cjelokupnih EAA.
Dakle potrebno je uzeti kompletne proteine kako bi došlo do povećanja MPS.
Postoje određene doze uzetih proteina koje trebaju biti zadovoljene kako bi došlo do adekvatne MPS.
Za taj odgovor se bitnom pokazala izvanstanična koncentracija aminokiselina umjesto intracelularne.

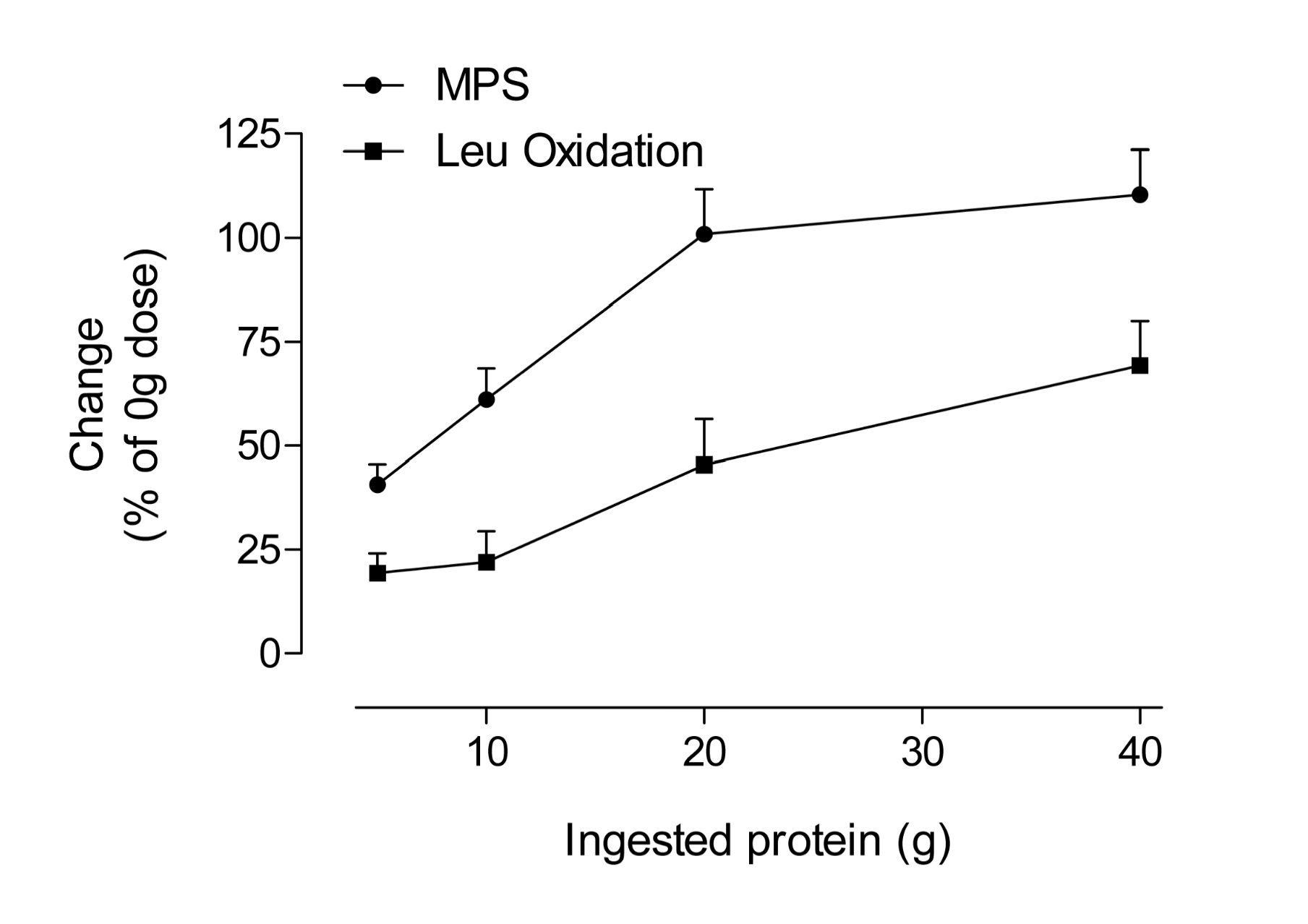
Utvrđeno da se zastoj (plato), kod sinteze proteina u mišićima MPS javlja kod doza esencijalnih aminokiselina od oko 8,5 grama do oko 10grama. Ili drugim riječima plato se dešava kada uzmete dozu od oko 20 grama proteina.
Slika dolje prikazuje oksidaciju leucina kao indeks katabolizma aminokiselina. Ono što je vidljivo je da se prekomjerno uzete aminokiseline jednostavno sagorjevaju kao gorivo.
Slika također pokazuje da je nepotrebno konzumiranje velike količine aminokiselina i/ili proteina u uvjerenju da će to ubrzati dobitke na mišićnoj masi.
Pokazalo se da će konzumiranje oko 20 grama visokokvalitetnih proteina (ili oko 0,25 g proteina/kg tjelesne mase/obroku), maksimalno stimulirati proces koji dovodi do pozitivnih promjena u mišićnoj masi.
Naravno da će fizički veći sportaši trebati više proteina kako bi se povećala sintezu mišićnog proteina MPS.
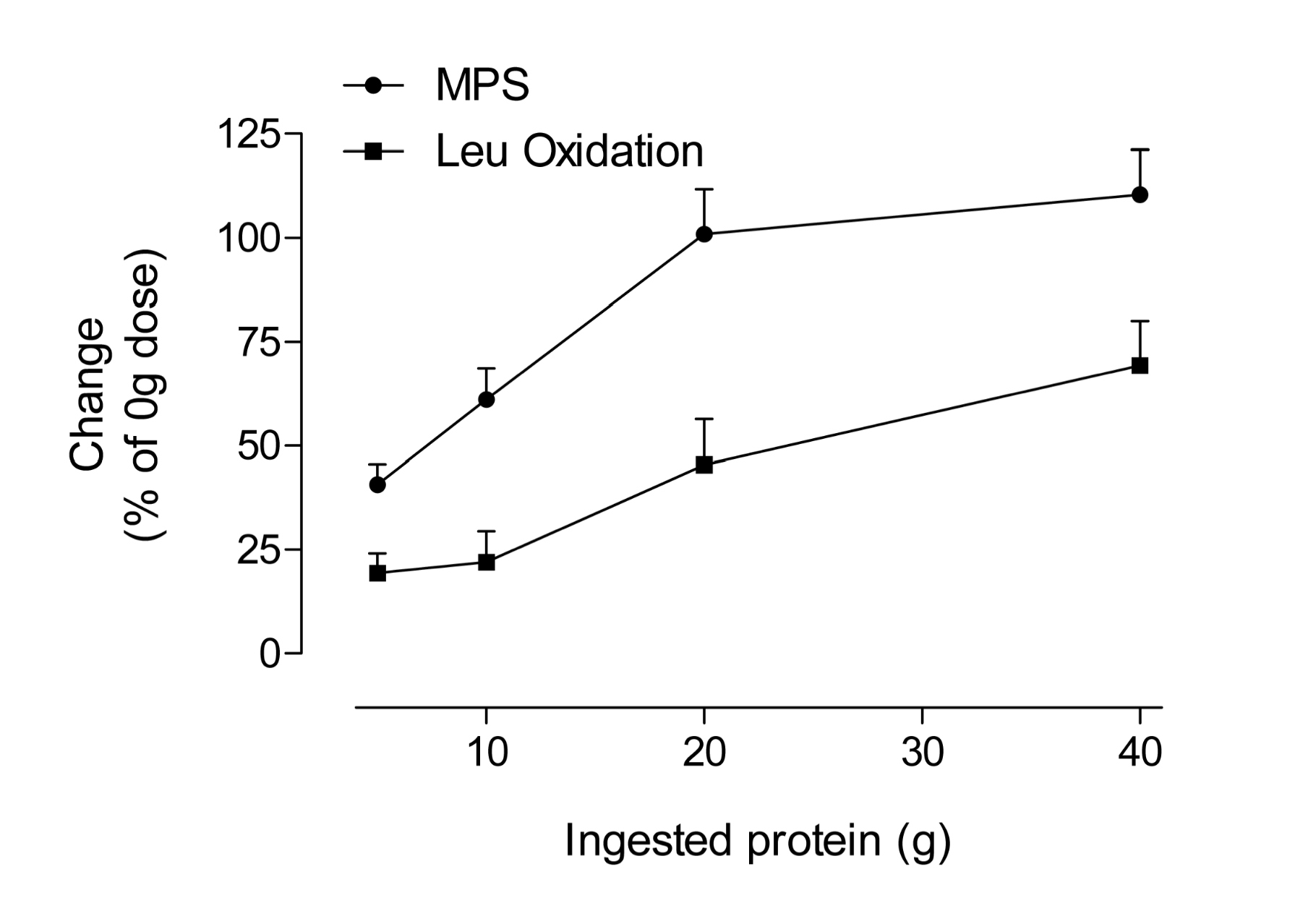
Slika: Postotak povećanja (od bazalnih ili 0 g), sinteze mišićnih proteina (MPS) i oksidacije leucina nakon treninga sa opterećenem kod mladih ljudi nakon uzimanja proteina i leucina.
REFERENCE:
Biolo, G., K. D. Tipton, S. Klein, and R. R. Wolfe (1997). An abundant supply of amino acids enhances the metabolic effect of exercise on muscle protein. Am. J. Physiol. 273: E122-E129.
Bohe, J., J. F. Low, R. R. Wolfe, and M. J. Rennie (2001). Latency and duration of stimulation of human muscle protein synthesis during continuous infusion of amino acids. J. Physiol. 532: 575-579.
Bohe, J., A. Low, R. R. Wolfe, and M. J. Rennie (2003). Human muscle protein synthesis is modulated by extracellular, not intramuscular amino acid availability: a dose-response study. J. Physiol. 552: 315-324.
Breen, L., and S. M. Phillips (2012). Nutrient interaction for optimal protein anabolism in resistance exercise. Curr. Opin. Clin. Nutr. Metab. Care 15: 226-232.
Burd, N.A., D. W. West, D. R. Moore, P. J. Atherton, A. W. Staples, T. Prior, J. E. Tang, M. J. Rennie, S. K. Baker, and S. M. Phillips (2011). Enhanced amino acid sensitivity of myofibrillar protein synthesis persists for up to 24 h after resistance exercise in young men. J. Nutr. 141: 568-573.
Churchward-Venne, T.A., N. A. Burd, and S. M. Phillips (2012). Nutritional regulation of muscle protein synthesis with resistance exercise: strategies to enhance anabolism. Nutr. Metab. (Lond.) 9: 40.
Fouillet, H., F. Mariotti, C. Gaudichon, C. Bos, and D. Tome (2002). Peripheral and splanchnic metabolism of dietary nitrogen are differently affected by the protein source in humans as assessed by compartmental modeling. J. Nutr. 132: 125-133.
Fujita, S., H. C. Dreyer, M. J. Drummond, E. L. Glynn, J. G. Cadenas, F. Yoshizawa, E. Volpi, and B. B. Rasmussen (2007). Nutrient signalling in the regulation of human muscle protein synthesis. J. Physiol. 582: 813-823.
Fujita, S., H. C. Dreyer, M. J. Drummond, E. L. Glynn, E. Volpi, and B. B. Rasmussen (2009). Essential amino acid and carbohydrate ingestion before resistance exercise does not enhance postexercise muscle protein synthesis. J. Appl. Physiol. 106: 1730-1739.
Glass, D.J. (2010). Signaling pathways perturbing muscle mass. Curr. Opin. Clin. Nutr. Metab. Care 13: 225-229.
Karlsson, H.K., P. A. Nilsson, J. Nilsson, A. V. Chibalin, J. R. Zierath, and E. Blomstrand (2004). Branched-chain amino acids increase p70S6k phosphorylation in human skeletal muscle after resistance exercise. Am. J. Physiol. 287: E1-E7.
Mitchell, C.J., T. A. Churchward-Venne, D. D. West, N. A. Burd, L. Breen, S. K. Baker, and S. M. Phillips (2012). Resistance exercise load does not determine training-mediated hypertrophic gains in young men. J Appl. Physiol. 113:71-77.
Moore D.R., M. J. Robinson, J. L. Fry, J. E. Tang, E. I. Glover, S. B. Wilkinson, T. Prior, M. A. Tarnopolsky, and S. M. Phillips (2009a). Ingested protein dose response of muscle and albumin protein synthesis after resistance exercise in young men. Am. J. Clin. Nutr. 89: 161-168.
Moore, D.R., J. E. Tang, N. A. Burd, T. Rerecich, M. A. Tarnopolsky, and S. M. Phillips (2009b). Differential stimulation of myofibrillar and sarcoplasmic protein synthesis with protein ingestion at rest and after resistance exercise. J. Physiol. 597: 897-904.
Pennings, B., Y. Boirie, J. M. Senden, A. P. Gijsen, H. Kuipers, and L. J. van Loon (2011). Whey protein stimulates postprandial muscle protein accretion more effectively than do casein and casein hydrolysate in older men. Am. J. Clin. Nutr. 93: 997-1005.
Phillips, S.M., K. D. Tipton, A. Aarsland, S. E. Wolf, and R. R. Wolfe (1997). Mixed muscle protein synthesis and breakdown after resistance exercise in humans. Am. J. Physiol. 273: E99-E107.